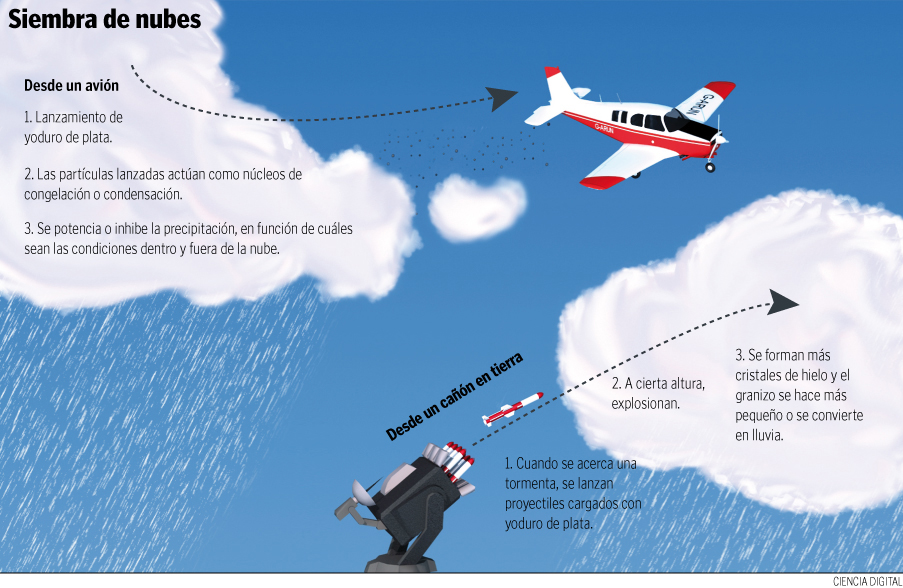
En el post anterior se explicó brevemente en qué consistía la siembra de nubes pero todavía hay varias cuestiones sobre este tema como... ¿para qué queremos lluvia artificial? ¿cuáles son sus beneficios? y lo más importante ¿cuáles son sus efectos en el medio ambiente?
Hoy en día, cerca de 24 países practican la modificación del clima, algunos de los usos más conocidos fueron los Juegos Olímpicos de 2008. En Pekín,, se utilizó la siembra antes de que empezaran los Juegos con el fín de limpiar el aire de contaminado, de ese modo llovió y permitió que los Juegos se celebraran con un Sol radiante.
Otra de las ocasiones en las que se usó la siembra fue después de accidente de Chernóbil, los pilotos militares rusos sembraron nubes en Bielorrusia para eliminar las partículas radioactivas de las nubes en dirección a Moscú.
Estas son algunas de las ocasiones en las que poder controlar la lluvia ha sido beneficioso para la humanidad. Y es que algunas de las ventajas de la siembra de nubes son:
-Es útil en aviación para eliminar la niebla y las nubes en los aeropuertos
-Se puede utilizar como herramienta para la extinción de incendios forestales
-La modificación del clima puede ayudar en la prevención y gestión de desastres naturales.
- Podríamos considerar que al utilizar un producto químico artificial como es el AgI (yoduro de plata) puede causar efectos nocivos sobre el medio ambiente, pero no es así. Según la DECLARACIÓN DE LA ASOCIACIÓN PARA LA MODIFICACIÓN DEL CLIMA (WEATHER MODIFICATION ASSOCIATION, WMA) SOBRE EL IMPACTO QUE CAUSA EN EL MEDIO AMBIENTE EL USO DE YODURO DE PLATA PARA LA SIEMBRA DE NUBES JULIO DE 2009 se observa que el AgI es inocuo tanto para flora como la fauna.
- Sin embargo, el hielo seco o CO2 en estado sólido, es uno de los mayores contaminantes atmosféricos ya que contribuye a la disminución de la capa de ozono con el consiguiente aumento del efecto invernadero. Se usa, por que es uno de los productos químicos más económicos para la función que realiza, y es fácil de obtener.
Por último, acabaré con una definición:
Conocimiento: es lo que nos permite tomar decisiones y actuar, es una información dirigida a la realización de una actividad, a solucionar un problema.
Ahora que ya conocemos un poco más en que consiste la siembra de nubes ¿estás a favor o en contra de su utilización?